 All’inizio di settembre, gli scienziati dell’Università della Florida hanno confermato che un delfino – la cui carcassa era stata trovata a marzo scorso in un canale, lungo la Costa del Golfo – presentava un tipo di influenza aviaria altamente patogeno. Aveva un’infiammazione cerebrale.
All’inizio di settembre, gli scienziati dell’Università della Florida hanno confermato che un delfino – la cui carcassa era stata trovata a marzo scorso in un canale, lungo la Costa del Golfo – presentava un tipo di influenza aviaria altamente patogeno. Aveva un’infiammazione cerebrale.
Come dice il nome stesso, il virus dell’influenza aviaria è molto abile nel contagiare gli uccelli, ma talvolta si spinge oltre e prende altre direzioni. Pochi mesi dopo la morte del tursiope, un altro mammifero marino – una focena – è stato trovato spiaggiato e in fin di vita sulla costa occidentale svedese. Poco dopo il ritrovamento, la focena è deceduta, colpita dal medesimo virus. Tra questi due casi, ce n’è stato uno più preoccupante ancora in Colorado: dopo alcune analisi di laboratorio, un uomo è risultato positivo all’influenza aviaria. Era un carcerato impegnato a lavorare in vista della scarcerazione in un impianto di pollame, nel quale doveva procedere all’abbattimento selettivo dei volativi colpiti dal contagio.
Altre analisi hanno messo in discussione il contagio del soggetto, sussistendo il dubbio che il tampone di controllo potesse essere entrato semplicemente in contatto con virus presenti nel suo naso. Tuttavia, quello del carcerato canadese non è stato l’unico caso di essere umano risultato positivo all’influenza aviaria – per la precisione l’H5N1 – l’anno scorso. Intorno al Natale del 2021, anche un britannico di 79 anni, che viveva in contatto stretto con una ventina di anatre di sua proprietà, è risultato positivo al virus dell’influenza aviaria.
Se questi quattro eventi – un delfino morto, una focena morta, due uomini risultati positivi a un pericoloso virus aviario – non vi appaiono in relazione tra loro e vi sembrano insignificanti, forse dipende dal fatto che non avete sentito parlare di “viral chatter”, espressione coniata vari decenni fa il dottor Donald Burke, esperto ricercatore di malattie infettive ed ex rettore della University of Pittsburgh Graduate School of Public Health, per indicare il momento in cui un virus effettua in modo episodico un salto di specie, passando da animali selvatici a esseri umani e provocando talvolta una piccola catena di contagi. Si tratta di un segnale d’allarme dei focolai, spesso riconosciuto quando ormai è troppo tardi.
L’idea di viral chatter in sostanza allude all’emissione di un breve segnale periodico quando avviene un salto di specie
mi ha detto il dottor Burke undici anni fa.
I virus degli uccelli passano ai mammiferi. I virus dei pipistrelli passano agli uomini. Di solito, questi focolai e contagi occasionali arrivano a un punto morto, il che è un bene. Ma “occasionali” significa anche che uno schema si ripete, il che è male – o quanto meno allarmante. Ciò che questo schema segnala alle persone avvedute come il dottor Burke è che un dato virus “vuole” superare il divario tra ospiti animali ed esseri umani e diffondersi ovunque.
Dire che un virus “vuole” fare qualcosa è antropomorfismo, naturalmente, perché i virus non sono dotati di volontà propria. È soltanto la mera convenienza, e non un’intenzione malvagia, a determinare il loro comportamento. L’antropomorfismo, in ogni caso, può tornare utile. I segnali dell’influenza H5N1 indicano che il virus sta esplorando le sue prospettive tra vari mammiferi. Faremmo bene a ricordare che ciò ci riguarda direttamente da vicino.
Sono due le domande sul “viral chatter” che formulano gli esperti di malattie infettive: stiamo ascoltando con sufficiente attenzione per capire quello che implicano? Siamo pronti ad agire?
Non ogni persona contagiata diventa il paziente zero di un focolaio di considerevoli dimensioni, per non parlare di una pandemia. Tuttavia, quanti più casi si presentano – e tanti più segnali vi sono – tanto più è grande la possibilità che un contagio porti alla catastrofe. Gli esseri umani vivono molto vicini tra loro e sono interconnessi, il che significa che costituiscono una grandissima opportunità per qualsiasi virus in grado di contagiare i mammiferi.
L’H5N1 è soltanto uno di numerosi sottotipi di febbre aviaria passati all’uomo negli ultimi decenni, e le influenze sono soltanto uno dei modi con i quali i virus sono capaci di effettuare il salto tra specie. Ovviamente, i coronavirus sono altro ancora.
Quando nel luglio 2003 terminò l’epidemia originaria di Sars, sembrò che il virus fosse stato sradicato tra gli esseri umani – anche se in natura continuava a esistere. Però, quando dal dicembre 2003 al gennaio 2004 si presentarono quattro nuovi casi tra gli esseri umani, si scoprì che il virus aveva effettuato di nuovo un salto di specie, a quanto pare in un ristorante dove si tenevano in gabbia zibetti delle palme (ospiti intermedi del virus) serviti come pietanza. Ciò portò a due in un solo anno i casi di salto di specie del virus Sars. Quanti altri casi, però, non furono segnalati?
Il virus Nipah, altro esempio, fu individuato tra gli esseri umani in Malesia nel 1998, quando effettuò un primo salto di specie dai pipistrelli, tra i quali è di casa, ai maiali e un secondo salto ancora da questi ai coltivatori di maiali e ai commercianti di carne di maiale. I pipistrelli della frutta che lo ospitano sono molto diffusi un po’ ovunque in Asia meridionale e da allora il virus Nipah ha provocato decine di focolai in Bangladesh e in India orientale. Il suo tasso di letalità arriva ben al 75 per cento ma, per nostra fortuna, non si trasmette facilmente da persona a persona. La prossima volta che si presenterà può darsi che lo faccia… Riuscite a sentire i segnali?
«Non simulerò di essere un veggente» mi disse il dottor Burke. Previsione, disse, era una parola già molto forte per quello che faceva. «In ogni caso, si può affermare che da quella zona si sentono arrivare segnali, che si tratta di una zona pericolosa e che questi sono i virus di cui dovremmo preoccuparci». Le previsioni informate sulle aree a rischio rendono possibili due aspetti importanti per la prevenzione di una pandemia: la vigilanza nei riguardi dei contagi più inverosimili e dello scoppio imminente di un’epidemia per intervenire per tempo, e una risposta efficace e immediata per contenere i contagi e impedire che si diffondano. La necessità di una seria vigilanza sui virus non è nuova. Subito dopo che fu fondata nel 1948, l’Organizzazione Mondiale della Sanità predispose un osservatorio globale sull’influenza e un sistema di intervento (Global Influenza Surveillance and Response System), una rete di laboratori e di centri di coordinamento miranti a individuare e risalire ai ceppi influenzali, registrarne i trend, monitorare gli interventi di politica sanitaria nel mondo. Questo sforzo coinvolge oggi alcune istituzioni di primaria importanza in 124 Stati facenti parte dell’Oms e prevede la condivisione a livello globale delle informazioni genetiche ed epidemiologiche raccolte. Nel 2000, nella preoccupazione crescente di altri virus emergenti, i membri dell’Oms hanno creato qualcosa di più ambizioso ancora, il Global Outbreak Alert and Response Network, ideato per aiutare i Paesi nei quali dovessero presentarsi dei focolai a impedirne la diffusione a livello globale. Da allora, nel corso degli anni, sono state varate molte più iniziative e organizzazioni. Di recente, però, ho parlato di influenza aviaria con cinque illustri ricercatori di varie parti del mondo, chiedendo a ciascuno di essi un parere sulla vigilanza esercitata. Le loro risposte sono state cinque variazioni di “inadeguatezza”.
Uno dei modi migliori per esercitare la vigilanza è sottoporre a esami del sangue e di altri campioni biologici le persone apparentemente sane che vivono in situazioni di rischio, per esempio i coltivatori di pollame o di suini (che possono fungere da intermediari per i virus influenzali) o chi lavora nei mercati dove si vendono animali vivi in gabbia, uccelli e mammiferi le cui deiezioni si spargono ovunque e che respirano l’aria di un medesimo ambiente chiuso. Un altro modo molto efficace per vigilare sullo scoppio di un focolaio è la campionatura preventiva degli animali selvatici con i quali gli esseri umani vengono in contatto, per esempio le prede catturate dai cacciatori, i roditori che infestano gli edifici, le anatre e le oche selvatiche che si mescolano ai loro simili domestici nelle mangiatoie o negli specchi d’acqua all’aperto. In parte, in alcune comunità e situazioni commerciali lo si fa già, ma secondo gli esperti non lo si fa abbastanza.
I motivi dell’inadeguatezza comprendono errori delle organizzazioni, finanziamenti limitati, alcuni aspetti economici dell’industria del pollame, il mercato nero degli animali selvatici e lo scarso impegno da parte dei governi nazionali e locali. Nei Paesi a basso reddito vi è anche penuria di tecnici e di veterinari preparati, come anche una resistenza a condividere le informazioni e i dati e una certa opposizione a controllare i soggetti sani ma a rischio, mentre tra le nazioni più potenti e con buone risorse circolano sospetti reciproci (esacerbati dall’esperienza con la Covid-19).
L’inadeguatezza è deplorevole e pericolosa. Viviamo in un mondo di virus che stanno all’interno di creature cellulari di tutti i tipi: animali, piante, funghi, protozoi, batteri e altri microbi. Centinaia di migliaia di questi virus nei mammiferi e negli uccelli possono contagiare l’uomo, e il contagiato potrebbe essere in grado di trasmettere il virus a un’altra persona, e poi a un’altra e un’altra ancora. Se non sentiamo i segnali è soltanto perché non stiamo ascoltando attentamente.
David Quammen su The New York Times 31 ottobre 2022
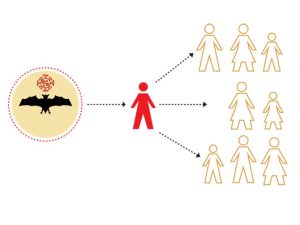 In questi anni abbiamo sentito parlare parecchio di spillover, che letteralmente identifica un “salto di specie” ma che più spesso viene inteso come passaggio di un patogeno dagli animali all’uomo. Tale meccanismo può essere alla base di malattie nuove o emergenti o vere e proprie epidemie/pandemie, come nel caso dell’influenza e probabilmente del SARS_CoV-2.
In questi anni abbiamo sentito parlare parecchio di spillover, che letteralmente identifica un “salto di specie” ma che più spesso viene inteso come passaggio di un patogeno dagli animali all’uomo. Tale meccanismo può essere alla base di malattie nuove o emergenti o vere e proprie epidemie/pandemie, come nel caso dell’influenza e probabilmente del SARS_CoV-2. Le chance di rintracciare l’antenato di Covid-19 sono ormai quasi nulle. Questa, in estrema sintesi, è la conclusione a cui giunge un approfondimento pubblicato sulla rivista Nature, in cui si ripercorrono gli sforzi effettuati dalla ricerca per ricostruire le origini della pandemia. Stando alle conoscenze attuali, spiegano i virologi, SARS-CoV-2 potrebbe aver condiviso un antenato con i coronavirus dei pipistrelli più recentemente di quanto precedentemente ipotizzato. Individuare le origini dell’agente patogeno, però, è molto più complesso di quanto si possa immaginare. I virus possono infatti scambiare tra loro frammenti di RNA, attraverso un processo chiamato ricombinazione. In un’analisi presentata durante il World One Health Congress a Singapore, gli scienziati hanno confrontato frammenti di genomi di coronavirus per cercare di individuare le origini di Covid-19. L’indagine suggerisce che alcune sezioni di coronavirus di pipistrello e SARS-CoV-2 condividevano un antenato comune nel 2016, appena tre anni prima dell’inizio della pandemia. Questo lavoro, che non è ancora stato sottoposto a revisione paritaria, restringe l’arco di tempo intercorso tra l’antenato di SARS-CoV-2 originato nei pipistrelli e l’agente patogeno che ha provocato l’emergenza sanitaria globale. I risultati, tuttavia, non contribuiscono alla spiegazione puntuale di come e quando sia avvenuto il salto.
Le chance di rintracciare l’antenato di Covid-19 sono ormai quasi nulle. Questa, in estrema sintesi, è la conclusione a cui giunge un approfondimento pubblicato sulla rivista Nature, in cui si ripercorrono gli sforzi effettuati dalla ricerca per ricostruire le origini della pandemia. Stando alle conoscenze attuali, spiegano i virologi, SARS-CoV-2 potrebbe aver condiviso un antenato con i coronavirus dei pipistrelli più recentemente di quanto precedentemente ipotizzato. Individuare le origini dell’agente patogeno, però, è molto più complesso di quanto si possa immaginare. I virus possono infatti scambiare tra loro frammenti di RNA, attraverso un processo chiamato ricombinazione. In un’analisi presentata durante il World One Health Congress a Singapore, gli scienziati hanno confrontato frammenti di genomi di coronavirus per cercare di individuare le origini di Covid-19. L’indagine suggerisce che alcune sezioni di coronavirus di pipistrello e SARS-CoV-2 condividevano un antenato comune nel 2016, appena tre anni prima dell’inizio della pandemia. Questo lavoro, che non è ancora stato sottoposto a revisione paritaria, restringe l’arco di tempo intercorso tra l’antenato di SARS-CoV-2 originato nei pipistrelli e l’agente patogeno che ha provocato l’emergenza sanitaria globale. I risultati, tuttavia, non contribuiscono alla spiegazione puntuale di come e quando sia avvenuto il salto.
 All’inizio di settembre, gli scienziati dell’Università della Florida hanno confermato che un delfino – la cui carcassa era stata trovata a marzo scorso in un canale, lungo la Costa del Golfo – presentava un tipo di influenza aviaria altamente patogeno. Aveva un’infiammazione cerebrale.
All’inizio di settembre, gli scienziati dell’Università della Florida hanno confermato che un delfino – la cui carcassa era stata trovata a marzo scorso in un canale, lungo la Costa del Golfo – presentava un tipo di influenza aviaria altamente patogeno. Aveva un’infiammazione cerebrale. Dal monitoraggio costante la scoperta del nuovo virus del pipistrello in Lombardia
Dal monitoraggio costante la scoperta del nuovo virus del pipistrello in Lombardia I nanomateriali sono materiali naturali, derivati o fabbricati contenenti particelle allo stato libero, aggregato o agglomerato, con almeno una delle dimensioni compresa tra 1 e 100 nanometri.
I nanomateriali sono materiali naturali, derivati o fabbricati contenenti particelle allo stato libero, aggregato o agglomerato, con almeno una delle dimensioni compresa tra 1 e 100 nanometri. Anticorpi monoclonali, sviluppati in IZS, permetteranno una più efficiente diagnosi di una malattia virale che colpisce prevalentemente i cervi, ma che può attaccare anche i bovini danneggiando la produzione di latte
Anticorpi monoclonali, sviluppati in IZS, permetteranno una più efficiente diagnosi di una malattia virale che colpisce prevalentemente i cervi, ma che può attaccare anche i bovini danneggiando la produzione di latte L’Istituto Superiore di Sanità ha pubblicato, nell’ambito dei Rapporti ISTISAN, il rapporto “Sorveglianza delle zanzare in Italia” a cura di Marco Di Luca del Dipartimento Malattie Infettive del ISS.
L’Istituto Superiore di Sanità ha pubblicato, nell’ambito dei Rapporti ISTISAN, il rapporto “Sorveglianza delle zanzare in Italia” a cura di Marco Di Luca del Dipartimento Malattie Infettive del ISS. Gli
Gli  L’articolo è stato pubblicato sulla rivista ‘The Lancet Planetary Health’, fra gli autori anche due ricercatori dell’Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), per gli ambiti di rabbia e malattie delle api.
L’articolo è stato pubblicato sulla rivista ‘The Lancet Planetary Health’, fra gli autori anche due ricercatori dell’Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), per gli ambiti di rabbia e malattie delle api.